化学键
【VR教学目标】
知识目标:
1. 使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解;
2. 能较为熟练地用电子式表示共价分子的形成过程和分子结构;
3. 理解极性键、非极性键、化学键的概念。
【教学重点与难点】
重点:氨共价键和共价化合物的概念;用电子式表示共价化合物的形成过程。
难点:用电子式表示共化合物的形成过程;极性键与非极性键的判断。
【VR教学过程】
一、课堂导入
上节课我们介绍了化学键中的离子键,本节课我们再来认识另一种类型的化学键—共价键。
二、讲授新课
什么是共价键呢?我们初中所学的共价化合物的知识可以帮助我们找到答案。
请大家看以下实验,并描述实验现象
[多媒体课件演示]
氢气在盛有氯气的集气瓶中燃烧。
【板书】H2+Cl2====2HCl
【板书】 原子之间通过共用电子对所形成的相互作用,叫做共价键。
【老师】氢原子与氯原子结合成氯化氢分子的过程,我们可用下列动画形象地表示出来。
【老师】从氯原子和氢原子的结构来分析,由于氯和氢都是非金属元素,不仅氯原子易得一个电子形成最外层8个电子的稳定结构,而且氢原子也易获得一个电子,形成最外层两个电子的稳定结构。这两种元素的原子获得电子难易的程度相差不大,所以相遇时都未能把对方的电子夺取过来。这两种元素的原子相互作用的结果是双方各以最外层一个电子组成一个电子对,电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构。这种电子对,就是共用电子对。共用电子对受两个核的共同吸引,使两个原子结合在一起。在氯化氢分子里,由于氯原子对于电子对的吸引力比氢原子的稍强一些,所以电子对偏向氯原子一方。因此,氯原子一方略显负电性,氢原子一方略显正电性,但作为分子整体仍呈电中性。以上过程也可以用电子式表示如下:
【板书】
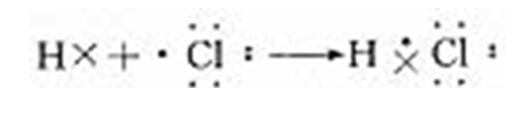
【老师】为什么用电子式表示离子化合物与表示共价化合物有如此区别呢?这是因为在氯化氢分子中,共用电子对仅发生偏移,没有发生电子得失,未形成阴、阳离子,因此,书写共价化合物的电子式不能标电荷。而氯化钠形成过程中钠原子完全失去电子给氯原子形成钠离子和氯离子。因此两者电子式的表示是不同的,同学们要注意这点区别。
[多媒体展示]练习:用电子式表示下列共价化合物的形成过程。CO2、NH3、CH4
学生活动,教师巡视,并让三个同学到黑板上各写一个:
【板书】
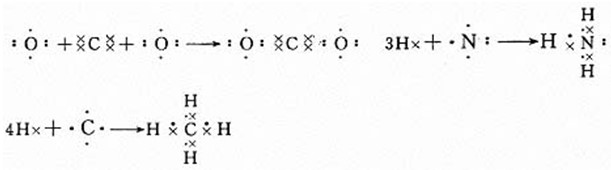
过渡:由以上分析可以知道,通过共用电子对可形成化合物的分子,那么,通过共用电子对,能不能形成单质的分子呢?下面,我们以氢分子为例,来讨论这个问题。
【老师】请大家用电子式表示氯气、氧气、氮气。
学生活动,教师巡视:对具有典型错误的写法进行分析、评价:
【板书】
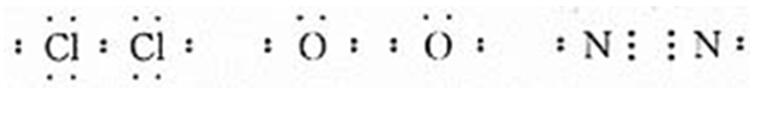
【老师】由此,我们得出以下结论:即同种或不同种非金属元素化合时,它们的原子之间都能通过共用电子对形成共价键(稀有气体除外)。
过渡:在化学上,我们常用一根短线来表示一对共用电子,这样得到的式子又叫结构式。以上提到的几种粒子,表示成结构式分别为:
【板书】
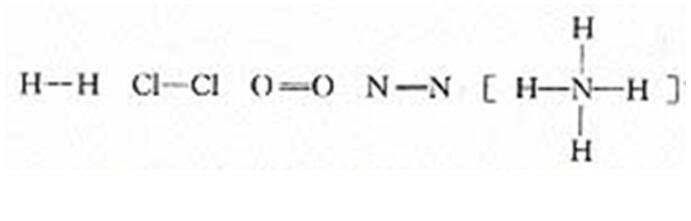
【老师】如果共价键中成键原子吸引电子的能力不同,共用电子对就偏向吸引电子能力强的原子,偏离吸引电子能力较弱的原子,使得共价键中正电荷重心和负电荷重心不相重合。键显极性。同种原子形成共价键,共用电子对不发生偏移,这样的共价键称为非极性键;不同种原子形成共价键,共用电子对偏向吸引电子能力强的一方,这样的共价键称为极性键。
播放VR教学视频(高中化学——物理化学——共价键)
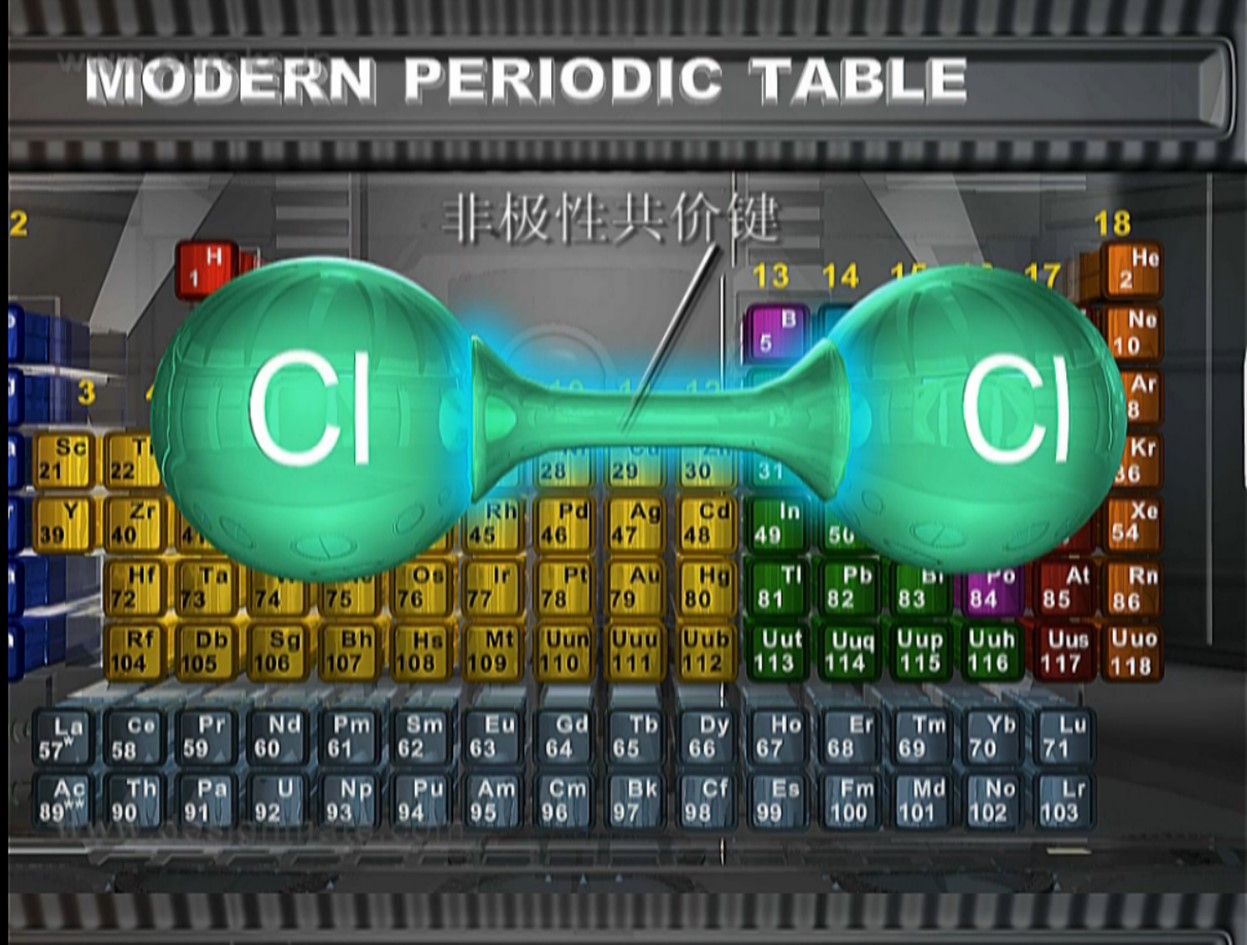
过渡:从有关离子键和共价键的讨论中,我们可以看到,原子结合成分子时,原子之间存在着相互作用。这种作用不仅存在于直接相邻的原子之间,而且也存在于分子内非直接相邻的原子之间。前一种相互作用比较强烈,破坏它要消耗比较大的能量,是使原子互相联结成分子的主要因素。我们把这种相邻的原子之间强烈的相互作用叫做化学键。
【板书】三、化学键:相邻的原子之间强烈的相互作用叫做化学键。
【板书】一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
【老师】请大家用化学键的观点来分析,H2分子与Cl2分子作用生成HCl分子的过程。
【学生】先是H2分子与Cl2分子中的H—H键、Cl—Cl键被破坏,分别生成氯原子和氢原子,然后氯原子与氢原子又以新的共价键结合成氯化氢分子。
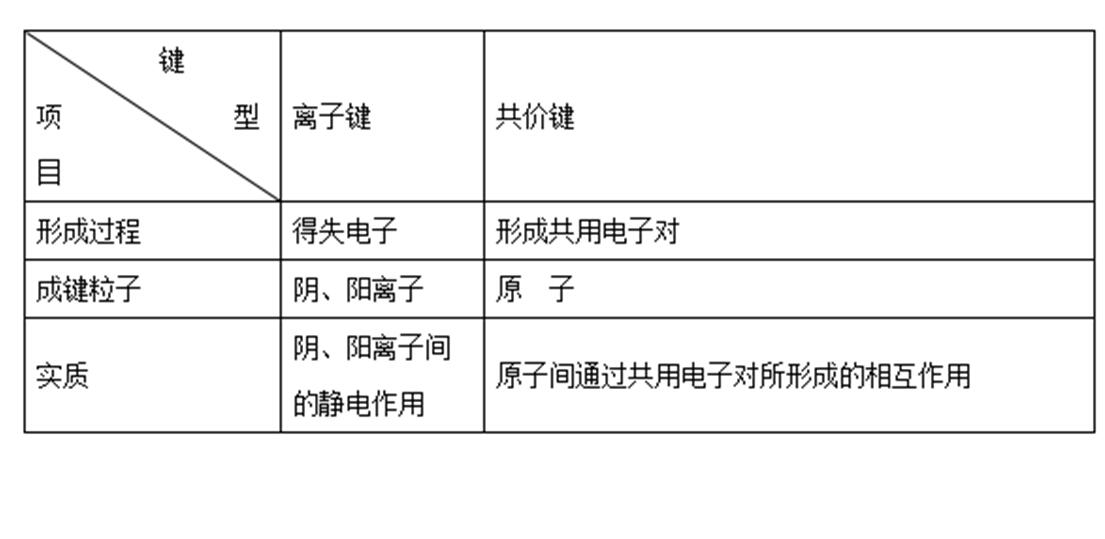
【老师】大家理解得很好。离子键和共价键是两种不同类型的化学键,现在播放一段VR教学视频(高中化学——物理化学——化学键合),请将它们之间的区别做出总结。
三、布置作业
书本习题